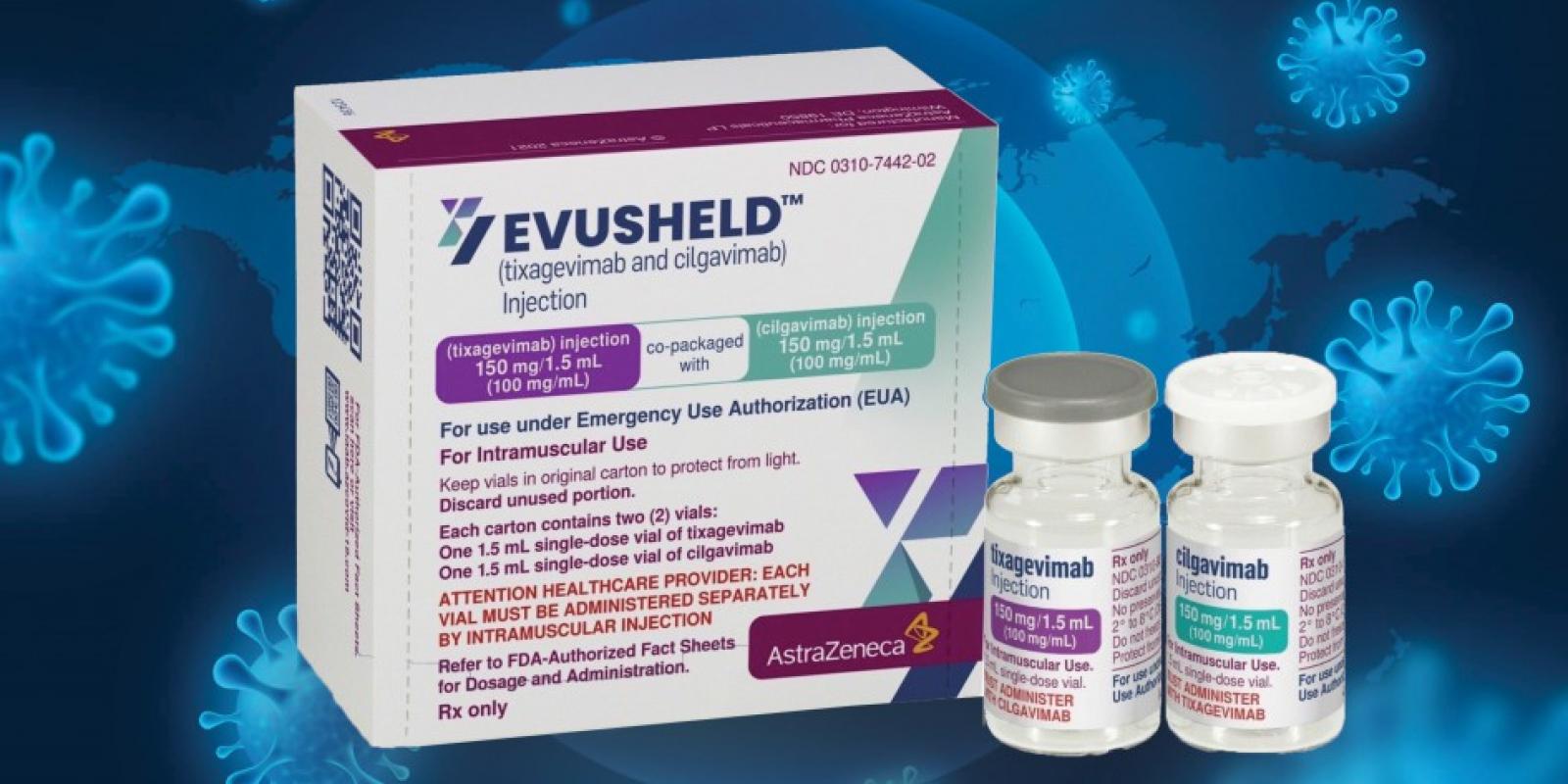
จากการทดลองใช้ยา Evusheld ของบริษัทแอสตร้าเซนเนก้า (เดิมชื่อ AZD7442) เพื่อป้องกันการติดเชื้อก่อนการสัมผัสโรคนั้น พบว่าสามารถลดความเสี่ยงของการติดเชื้อโควิด-19 แบบมีอาการ โดยไม่พบผู้ป่วยที่มีอาการรุนแรง หรือเสียชีวิตจากโรคโควิด-19 หลังได้รับยา
ผลการศึกษาระยะที่ 3 พรูฟเวนท์ (PROVENT) เป็นการทดลองในระยะที่ 3 แบบการสุ่มและปกปิดข้อมูลทั้งสองทาง และศึกษาควบคุมด้วยยาหลอก (Placebo) ภายในศูนย์ทดลองหลายแห่ง เพื่อให้ทราบถึงความปลอดภัย และประสิทธิภาพของการใช้ยา Evusheld ขนาด 300 มิลลิกรัม ฉีดเข้ากล้ามเนื้อ เทียบกับการใช้ยาหลอกในการป้องกันโรคโควิด-19 แบบมีอาการในกลุ่มผู้เข้าร่วมโครงการที่ไม่ได้เป็นโรคโควิด-19 ซึ่งได้ดำเนินการทดลองขึ้นทั้งหมด 87 แห่งในสหรัฐอเมริกา สหราชอาณาจักร สเปน ฝรั่งเศส และเบลเยี่ยม มีผู้เข้าร่วมโครงการเป็นจำนวน 5,197 คน โดยสุ่มรับยา Evusheld หรือยาหลอกในอัตรา 2:1 โดยมีผู้ได้รับยา Evusheld เป็นจำนวน 3,460 คน และมีคนได้รับน้ำเกลือเป็นยาหลอกจำนวน 1,737 คน ซึ่งเป็นการฉีดเข้ากล้ามเนื้อสองจุดต่อเนื่องกัน
ฉีดครั้งเดียว ป้องกันติดโควิดได้ 6 เดือน
การทดลองนี้เป็นการทดลองในระยะที่ 3 โครงการแรก ได้รับการออกแบบมาเพื่อประเมินผลโมโนโคลนอลแอนติบอดี้ (แอนติบอดี้ที่สร้างจากเซลล์เม็ดเลือดขาว) สำหรับการป้องกันก่อนการสัมผัสเชื้อไวรัสก่อโรคโควิด-19 โดยมีกลุ่มเป้าหมายคือผู้ที่มีความเสี่ยงสูงที่มีภูมิคุ้มกันตอบสนองต่อวัคซีนน้อยกว่าคนทั่วไป และผู้ที่มีความเสี่ยงสูงที่จะมีอาการรุนแรงจากโรคโควิด-19
สำหรับการป้องกันก่อนการสัมผัสเชื้อไวรัสก่อโรค พบว่าสามารถลดความเสี่ยงจากการเกิดโรคโควิด-19 แบบมีอาการได้ 77% จากการวิเคราะห์เบื้องต้น และ 83% จากการวิเคราะห์มัธยฐานระยะเวลา 6 เดือน เทียบกับกลุ่มที่ได้รับยาหลอก พบว่าไม่มีผู้ป่วยอาการร้ายแรงหรือการเสียชีวิตจากโรคโควิด-19 ตลอดการติดตามผลในระยะเวลา 6 เดือน
อย่างไรก็ดี มากกว่า 75% ของจำนวนผู้เข้าร่วมการศึกษาพรูฟเวนท์ มีโรคประจำตัว ซึ่งก่อให้เกิดความเสี่ยงสูงต่อการติดเชื้อไวรัสโควิด-19 ที่รุนแรง รวมถึงผู้ที่มีภูมิคุ้มกันบกพร่องและอาจมีภูมิคุ้มกันตอบสนองไม่เพียงพอต่อการรับวัคซีน
ข้อมูลเพิ่มเติมจากเภสัชจลนศาสตร์ (Pharmacokinetics) แสดงให้เห็นอีกว่า ความเข้มข้นของยา Evusheld ยังคงอยู่ในระดับที่สูงเป็นระยะเวลา 6 เดือน หลังการได้รับยา ซึ่งสนับสนุนได้ว่าการฉีดยาครั้งเดียวสามารถให้การป้องกันการติดเชื้อไวรัสก่อโรคโควิด-19 ได้อย่างน้อย 6 เดือน
ข้อมูลเหล่านี้ถูกตีพิมพ์ บนวารสารการแพทย์อย่าง New England Journal of Medicine เมื่อวันที่ 20 เม.ย. ที่ผ่านมาด้วย
ป้องกันกลุ่มเปราะบาง-ล้างไวรัสย่อย BA.2
นพ.ไมรอน เจ เลวิน ศาสตราจารย์ด้านกุมารเวชศาสตร์ และอายุรศาสตร์ คณะแพทยศาสตร์ มหาวิทยาลัยโคโลราโด ประเทศสหรัฐอเมริกา และผู้วิจัยหลักของการทดลองพรูฟเวนท์ เปิดเผยว่า ในขณะที่วัคซีนโควิด-19 มีประสิทธิภาพสูงในการช่วยลดจำนวนผู้ป่วยที่ต้องเข้ารับการรักษาในโรงพยาบาลและการเสียชีวิต แต่จำนวนผู้ป่วยติดเชื้อรายใหม่ยังคงเพิ่มขึ้นอย่างต่อเนื่อง และหลายคนยังมีความเสี่ยงสูง ซึ่งรวมไปถึงผู้ที่มีภูมิคุ้มกันบกพร่องและผู้ที่ไม่สามารถรับวัคซีนได้
“ข้อมูลเหล่านี้ถูกตีพิมพ์ในวารสาร New England Journal of Medicine สามารถทำให้มั่นใจได้ว่ายา Evusheld ที่ฉีดเข้ากล้ามเนื้อเพียงโดสเดียวสามารถให้การป้องกันแก่ประชาชนกลุ่มเปราะบางได้เป็นระยะเวลานาน ไม่เพียงเท่านั้น ยา Evusheld ยังสามารถลบล้างเชื้อไวรัสสายพันธุ์ย่อย BA.2 ซึ่งเป็นสายพันธุ์ที่ระบาดหลักในปัจจุบันได้” นพ.ไมรอน ระบุ
สอดคล้องกับ เมเน แพนกาลอส รองประธานบริหารฝ่ายวิจัยและพัฒนาด้านยาชีวเภสัชภัณฑ์ (Biopharmaceuticals) ของแอสตร้าเซนเนก้า กล่าวว่า ข้อมูลดังกล่าวเป็นหลักฐานสนับสนุนการใช้ยา Evusheld เพื่อการป้องกันการเกิดโรคโควิด-19 แบบมีอาการและการเกิดโรคโควิด-19 ที่มีอาการรุนแรง โดยเฉพาะอย่างยิ่งในผู้ที่ภูมิคุ้มกันตอบสนองไม่เพียงพอต่อการรับวัคซีนและต้องการการป้องกันที่เพิ่มขึ้น
“ปัจจุบันยา Evusheld มีใช้แล้วในหลายประเทศทั่วโลก การขึ้นทะเบียนกำลังคืบหน้าสำหรับทั้งการใช้ยาสำหรับการป้องกันก่อนการสัมผัสโรคและการใช้เพื่อรักษาผู้ป่วยโรคโควิด-19 ที่มีอาการเล็กน้อยถึงปานกลาง” รองประธานรายนี้ ระบุ
สำหรับ การวิเคราะห์ประสิทธิภาพเบื้องต้นของยา Evusheld สำหรับฉีดเข้ากล้ามเนื้อขนาด 300 มก. สามารถลดความเสี่ยงในการติดเชื้อโควิด-19 แบบมีอาการ ได้ถึง 77% เมื่อเทียบกับกลุ่มที่ได้รับยาหลอก (95% ช่วงความเชื่อมั่น (CI) 46-90; p <0.001) โดยมีค่ามัธยฐานในช่วงระยะเวลาติดตามหลังการได้รับยาไปแล้ว 83 วัน โดยพบผู้ติดเชื้อโควิด-19 แบบมีอาการเป็นสัดส่วน 8/3441 (0.2%) และ 17/1,731 (1.0%) ในกลุ่มที่ได้รับยา Evusheld และยาหลอกตามลำดับ
ผลการทดลอง 6 เดือน ไม่พบผู้ป่วยอาการรุนแรงจากโควิด-19
เมื่อเปรียบเทียบกับการวิเคราะห์ผลเบื้องต้น การวิเคราะห์ผลการติดตามที่ยาวนานขึ้นแสดงให้เห็นว่ายา Evusheld สามารถลดอุบัติการณ์ของโรคโควิด-19 ได้มากยิ่งขึ้น โดยสามารถลดความเสี่ยงสัมพัทธ์ (RRR) ได้ถึง 83% ในการติดเชื้อโควิด-19 แบบมีอาการ (95% ช่วงความเชื่อมั่น (CI) 66, 91) เมื่อเทียบกับกลุ่มที่ได้รับยาหลอก โดยมีค่ามัธยฐานในช่วงระยะเวลาติดตามหลังการได้รับยาไปแล้ว 196 วัน โดยพบผู้ติดเชื้อโควิด-19 แบบมีอาการเป็นสัดส่วน 11/3,441 (0.3%) และ 31/1731 (1.8%) ในกลุ่มที่ได้รับยา Evusheld และยาหลอกตามลำดับ ซึ่งประสิทธิภาพดังกล่าวนี้มีความสอดคล้องกันกับการประเมินในกลุ่มผู้เข้าร่วมรายย่อย
จากการติดตามผลในระยะเวลา 6 เดือนในกลุ่มผู้เข้าร่วมรับยา Evusheld นั้น ไม่พบผู้ป่วยที่มีอาการรุนแรงจากโรคโควิด-19 ไม่พบผู้ที่ติดเชื้อในระดับที่ต้องเข้ารักษาตัวในโรงพยาบาลหรือการเสียชีวิตที่เกี่ยวข้องกับโควิด-19 ส่วนกลุ่มที่ได้ยาหลอก มีผู้ป่วยโควิด-19 ที่มีอาการรุนแรง 5 ราย มีผู้ที่ต้องรักษาตัวในโรงพยาบาล 7 ราย และมีผู้เสียชีวิตจากโควิด-19 2 ราย
ยา Evusheld มีผลข้างเคียงที่ยอมรับได้ดีจากการศึกษาพรูฟเวนท์ (PROVENT) และไม่มีการระบุถึงปัญหาด้านความปลอดภัยตั้งแต่การวิเคราะห์ระยะแรกหรือแม้แต่ระยะ 6 เดือน เหตุการณ์ไม่พึงประสงค์ที่เกิดขึ้นมีอัตราใกล้เคียงกันในทั้งสองกลุ่ม โดยเหตุการณ์ไม่พึงประสงค์ที่พบบ่อยที่สุดคือปฏิกิริยาบริเวณที่ฉีดวัคซีน ซึ่งเกิดขึ้นใน 2.4% ของผู้เข้าร่วมที่รับยา Evusheld และ 2.1% ของผู้เข้ามร่วมที่รับยาหลอก
ประชากรทั่วโลกประมาณ 2% มีความเสี่ยงเพิ่มขึ้นที่จะมีการตอบสนองทางภูมิคุ้มกันต่อวัคซีนป้องกันโรคโควิด-19 ไม่เพียงพอ และอาจได้รับประโยชน์จากยา Evusheld ในการป้องกันก่อนการสัมผัสเชื้อไวรัสก่อโรคโควิด-192,3 ซึ่งประชากรดังกล่าวยังรวมถึงผู้ที่มีภาวะภูมิคุ้มกันบกพร่อง เช่น ผู้ป่วยมะเร็ง ผู้ป่วยที่ได้รับการปลูกถ่ายอวัยวะ ผู้ป่วยที่ได้รับยากดภูมิคุ้มกัน นอกจากนั้นแล้ว ผู้ที่มีความเสี่ยงเพิ่มขึ้นในการได้รับเชื้อไวรัส SARS-CoV-2 ก็สามารถได้รับประโยชน์จากการป้องกันด้วยยา Evusheld อีกด้วย
ก่อนหน้านี้ทางแอสตร้าเซนเนก้าได้ประกาศผลลัพธ์ที่ดีจากการทดลองแท็คเคิล (TACKLE) การศึกษาระยะที่ 3 เพื่อใช้ในการรักษาผู้ป่วยโควิด-19 ที่มีอาการเล็กน้อยถึงปานกลาง ซึ่งผลการศึกษาในฉบับเต็มจะถูกนำเสนอเข้าสู่ที่ประชุมสภาจุลชีววิทยาคลินิกและโรคติดเชื้อแห่งยุโรป (European Congress of Clinical Microbiology and Infectious Diseases หรือ ECCMID) ที่กำลังจะจัดขึ้น และยังได้ยื่นตีพิมพ์ในวารสารทางการแพทย์ที่ผ่านการตรวจสอบโดยผู้เชี่ยวชาญอีกด้วย
ทดลองจากกลุ่มคนที่มีภูมิคุ้มกันตอบสนองต่อวัคซีนไม่เพียงพอ
บทวิเคราะห์เบื้องต้นได้รายงานเมื่อวันที่ 20 ส.ค. 2564 มีผู้เข้าร่วมโครงการ 5,172 คน จากข้อมูล ณ วันที่ 5 พ.ค. 2564 ประสิทธิภาพระดับปฐมภูมิคือ การเกิดกรณีแรกที่พบการติดเชื้อ SARS-CoV-2 จากการตรวจ RT-PCR ที่เกิดขึ้นหลังจากได้รับการฉีดยาไปจนถึงวันที่183 ในการติดตามผลที่ระยะเวลา 6 เดือน นั้นประเมินจากข้อมูล ณ วันที่ 29 ส.ค. 2564 โดยจะยังคงมีการติดตามผู้เข้าร่วมโครงการต่อไปจนครบ 15 เดือน ผู้เข้าร่วมโครงการที่เลือกรับการฉีดวัคซีนในช่วงเวลาใดก็ได้ระหว่างการทดลองพรูฟเวนท์จะถูกรวมอยู่ในการวิเคราะห์ประสิทธิภาพจนถึงวันที่ได้รับวัคซีน
สำหรับ ผู้เข้าร่วมโครงการมีอายุ 18 ปีขึ้นไป และเป็นผู้ได้ประโยชน์จากยา Evusheld ซึ่งกลุ่มคนเหล่านี้เป็นกลุ่มคนที่มีภูมิคุ้มกันตอบสนองต่อวัคซีนไม่เพียงพอ (กลุ่มคนที่คาดว่าจะมีการตอบสนองต่อวัคซีนน้อยลงหรือไม่ตอบสนองเลย) หรือผู้ที่มีความเสี่ยงสูงที่จะติดเชื้อไวรัสก่อโรคโควิด-19 รวมถึงผู้ที่อยู่ในสถานที่ หรือสภาพแวดล้อมที่เสี่ยงต่อการแพร่ระบาดของโรคโควิด-19 ผู้เข้าร่วมโครงการจะได้รับการคัดกรองว่าไม่เคยได้รับวัคซีน และมีผลตรวจโควิด-19 ทางเซรุ่มวิทยาเป็นลบ
นอกจากนั้นมากกว่า 75% ของผู้เข้าร่วมโครงการพรูฟเวนท์ มีโรคประจำตัวและภาวะต่าง ๆ ที่มีความเสี่ยงต่อการเกิดโรครุนแรงจากโควิด-19 ซึ่งรวมถึงผู้ที่มีภาวะภูมิคุ้มกันบกพร่อง หรือผู้ที่ทานยากดภูมิคุ้มกัน ผู้ป่วยเบาหวาน โรคอ้วนรุนแรง โรคหัวใจ โรคปอดอุดกั้นเรื้อรัง โรคไตเรื้อรัง และโรคตับเรื้อรัง โดยผู้เข้าร่วมโครงการราว 43% มีอายุมากกว่า 60 ปีขึ้นไป
อนึ่ง ยา Evusheld เดิมชื่อ AZD7442 คือ แอนติบอดีออกฤทธิ์ยาว (Long-acting Antibody - LAAB) ที่ผสมยา LAAB สองชนิด ได้แก่ tixagevimab (AZD8895) และ cilgavimab (AZD1061) ซึ่งมาจากบีเซลล์ที่ได้รับการบริจาคจากผู้ที่เคยป่วยจากเชื้อไวรัส SARS-CoV-2 ซึ่งถูกค้นพบโดยศูนย์การแพทย์ของมหาวิทยาลัยแวนเดอร์บิวท์ และได้อนุญาตให้แอสตร้าเซนเนก้านำมาพัฒนาต่อเมื่อเดือนมิถุนายนปี 2563
โมโนโคลนอลแอนติบอดีของมนุษย์ 2 ตัวนี้จะมีความจำเพาะที่ต่างกัน เพื่อจับกับโปรตีนหนามของเชื้อไวรัสโควิด-19 หรือ SARS-CoV-27 ในคนละจุด และถูกพัฒนาต่อโดยแอสตร้าเซนเนก้า เพื่อขยายระยะเวลาครึ่งชีวิต (half-life) เพื่อเพิ่มความยืนยาวของแอนติบอดี้ และปรับให้มีการจับกันของ Fc Receptor และ Complement ชนิด C1q ที่ลดลง โดยการขยาย half-life นั้น สามารถเพิ่มความยืนยาวของแอนติบอดี้ได้มากกว่าสามเท่าเมื่อเทียบกับแอนติบอดี้ทั่วไป
จากข้อมูลของการทดลองในระยะที่ 3 แสดงให้เห็นว่าระดับของแอนติบอดีที่สามารถยับยั้งการเพิ่มจํานวนของไวรัส (neutralizing antibody) คงอยู่ได้เป็นระยะเวลาไม่ต่ำกว่า 6 เดือน และการปรับให้มีการจับของ Fc Receptor ที่ลดลงนั้นสามารถลดความเสี่ยงต่อภาวะ antibody-dependent enhancement (ADE) ซึ่งเป็นปรากฎการณ์ที่แอนติบอดี้ของเชื้อไวรัสเข้าไปกระตุ้นแทนที่จะยับยั้งการติดเชื้อ
ทั้งนี้ มีหลักฐานค้นคว้าในหลอดทดลองและการทดลองในสิ่งมีชีวิต (แบบใช้สัตว์) ที่แสดงให้เห็นว่ายา Evusheld สามารถป้องกันการติดเชื้อจากสายพันธุ์ย่อยโอมิครอน BA.1 BA.1.1 และ BA.2 จากการศึกษาของคณะแพทยศาสตร์ มหาวิทยาลัยวอชิงตัน ยังยืนยันถึงประสิทธิภาพของ Evusheld ในการลบล้างฤทธิ์ไวรัสโคโรนาสายพันธุ์ย่อย BA.2 และยังแสดงให้เห็นว่า Evusheld ลดปริมาณเชื้อไวรัสและมีประสิทธิภาพในการป้องกันการติดเชื้อในปอดต่อทุกสายพันธุ์ย่อยของไวรัสโคโรนาสายพันธุ์โอมิครอนได้
สำหรับยา Evusheld ได้รับการขึ้นทะเบียนตำรับยาในสหภาพยุโรป และได้รับการขึ้นทะเบียนวางจำหน่ายแบบมีเงื่อนไขจากหน่วยงานกำกับดูแลยาและผลิตภัณฑ์เพื่อสุขภาพ (MHRA) ของสหราชอาณาจักร สำหรับใช้เพื่อการป้องกันก่อนการสัมผัสเชื้อไวรัสก่อโรคโควิด-19 ยา Evusheld การขึ้นทะเบียนให้นำมาใช้ในภาวะฉุกเฉินสำหรับการป้องกันก่อนการสัมผัสเชื้อไวรัสก่อโรคโควิด-19 ในประเทศสหรัฐอเมริกาและยังได้รับอนุญาตให้นำมาใช้ และจำหน่ายในหลายประเทศทั่วโลก ทั้งนี้บริษัทกำลังดำเนินการยื่นทะเบียนยา Evusheld ไปยังหลายประเทศเพื่อการอนุมัติใช้ทั้งในแง่ของการป้องกัน และการรักษาโรคโควิด-19
นอกจากนี้ ยา Evusheld ที่กำลังพัฒนาอยู่นี้ได้รับการสนับสนุนจากรัฐบาลประเทศสหรัฐอเมริกา รวมไปถึงเงินทุนจากหน่วยงานด้านสุขภาพและบริการมนุษย์ของสหรัฐฯ ภายใต้การกำกับดูแลของ Office of the Assistant Secretary for Preparedness and Response และ Biomedical Advanced Research and Development Authority ภายใต้ความร่วมมือกับกระทรวงกลาโหม และ Joint Program Executive Office for Chemical, Biological, Radiological and Nuclear Defense ภายใต้สัญญาหมายเลข W911QY-21-9-0001 ภายใต้ข้อตกลงกับแวนเดอร์บิวท์ แอสตร้าเซนเนก้าจะจ่ายส่วนแบ่งค่าสิทธิจากยอดขายในอนาคต
- 477 views