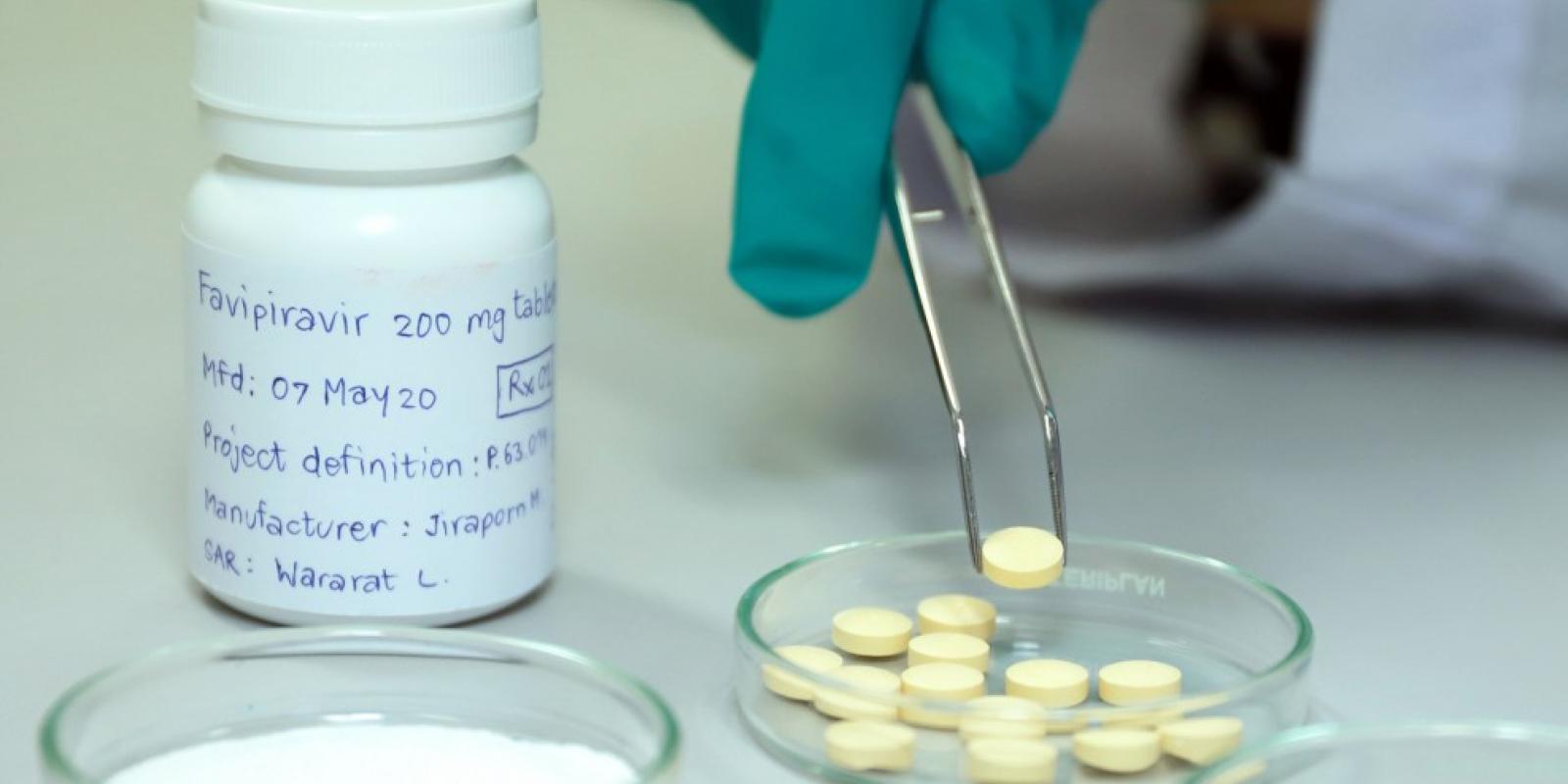
- ยาฟาวิพิราเวียร์ (Favipiravir) เป็น “ยาต้านไวรัส” ชนิดหนึ่งที่ถูกพัฒนาขึ้นโดยบริษัทญี่ปุ่น มีฤทธิ์ต่อต้านอาร์เอ็นเอไวรัสหลายชนิด ที่ผ่านมาใช้รักษาไวรัสไข้หวัดใหญ่ ไวรัสไข้เหลือง ฯลฯ และยังมีประสิทธิภาพต่อต้านไวรัสโควิด-19 ด้วย
- ทุกวันนี้ “ฟาวิพิราเวียร์” เป็นยาสำคัญในการรักษาโควิด-19 ของประเทศไทย โดยแพทย์จะจ่ายยานี้แก่ผู้ป่วยที่มีอาการปอดบวม หรือเสี่ยงต่อการเป็นโรครุนแรง
- ข้อมูลทางการแพทย์บ่งชี้ว่า หากผู้ป่วยได้รับยาฟาวิพิราเวียร์เร็ว ก็มีโอกาสที่จะรักษาโควิด-19 ได้ดีขึ้น ลดอัตราการครองเตียงในห้องไอซียู และลดอัตราการเสียชีวิต
- ยาฟาวิพิราเวียร์ที่ประเทศไทยใช้อยู่นั้น เป็น “ชนิดเม็ด” ผู้ป่วย 1 ราย ต้องรับประทานประมาณ 50-110 เม็ด (ขึ้นอยู่กับน้ำหนักตัว) ราคาอยู่ที่เม็ดละ 150 บาท โดยเฉลี่ยผู้ป่วย 1 ราย จะใช้ยามูลค่า 7,500-16,500 บาท
- สาเหตุที่ยาฟาวิพิราเวียร์มี “ราคาแพง” เนื่องจากไทยต้องนำเข้าจากต่างประเทศ โดยไทยสั่งซื้อมาจากบริษัทญี่ปุ่น
- มีข้อกังวลจากบุคลากรทางการแพทย์และนักวิชาการว่า นอกจากจะซื้อยาราคาแพงแล้ว ไทยยังมีความเสี่ยงต่อความไม่มั่นคงทางยา เนื่องจากต้อง “ยืมจมูกคนอื่นหายใจ” ตลอด
- มากไปกว่านั้น ทุกวันนี้บริษัทญี่ปุ่นได้ใช้ “อินเดีย” เป็นฐานผลิตยาฟาวิพิราเวียร์ ซึ่งอินเดียก็กำลังเผชิญกับวิกฤตโควิด-19 อย่างแสนสาหัส นั่นทำให้ในอนาคตอันใกล้นี้ อินเดียอาจมีข้อจำกัดเรื่องการผลิตยาและการส่งออกยา นั่นหมายถึงปริมาณยาจะลดลง ความต้องการยาจะเพิ่มขึ้น ประเทศไทยจะต้องซื้อยาที่แพงขึ้นอีก และท้ายที่สุดอาจร้ายแรงถึงขั้น “ขาดแคลนยา” ที่ใช้ในประเทศ
- สิ่งที่ย้อนแย้งกับสถานการณ์ที่เกิดขึ้นอยู่นี้ก็คือ ในความเป็นจริงแล้ว ประเทศไทยเองก็ “มีศักยภาพ” ในการผลิตยาฟาวิพิราเวียร์ได้ ซึ่งจะทำให้มีราคาถูกลง และลดพึ่งพาการนำเข้า
- มากไปกว่านั้น หากประเทศไทยผลิตยาฟาวิพิราเวียร์ใช้เองในประเทศ จะทำให้ราคายาถูกลง “เกินครึ่งหนึ่ง” จากราคาที่ซื้ออยู่ในปัจจุบัน
- ขณะนี้ องค์การเภสัชกรรม (อภ.) สามารถผลิตยาฟาวิพิราเวียร์ชนิดเม็ดออกมาได้แล้ว อยู่ระหว่างการตรวจสอบอีกเพียงเล็กน้อย ก็จะขอขึ้นทะเบียนกับ อย. ได้
- อย่างไรก็ตาม ถึงแม้ อภ. จะมีศักยภาพและดำเนินการผลิตยาฟาวิพิราเวียร์ออกมาได้แล้วก็จริง แต่ก็ยัง “ติดล็อก” ไม่สามารถนำออกมาจำหน่ายได้ เนื่องจากยังมีประเด็นเรื่อง “สิทธิบัตร” คาราคาซังอยู่
- อธิบายเรื่องของสิทธิบัตรให้เข้าใจง่ายๆ ก็คือ “สิทธิบัตร” คือการให้ความคุ้มครองสิ่งประดิษฐ์นั้นๆ เพื่อไม่ให้ลอกเลียนแบบในช่วงเวลาหนึ่ง ตัวอย่างเช่น “สิทธิบัตรยา” จะให้ความคุ้มครองเจ้าของสิทธิบัตร 20 ปี นั่นหมายความว่า ภายใน 20 ปีนับตั้งแต่ได้รับสิทธิบัตร จะห้ามมิให้ใครผลิตยาชนิดนี้ แต่หลังจากนั้นสามารถผลิตได้
- อย่างไรก็ตาม ผู้คิดค้นสิ่งประดิษฐ์นั้นๆ (ยา) จะต้องยื่นขอสิทธิบัตรเป็น “รายประเทศ” เช่น หากต้องการนำยาที่ตัวเองคิดค้นขึ้นมาขายในประเทศไทย ก็ต้องยื่นขอสิทธิบัตรในประเทศไทย หากประเทศไทยอนุมัติสิทธิบัตร ก็จะเกิดความคุ้มครองเฉพาะในประเทศไทยเท่านั้น ส่วนประเทศอื่นๆ ก็ต้องไล่ขอสิทธิบัตรเป็นประเทศๆ ไป
- เรื่องของเรื่องก็คือ สิทธิบัตรที่เกี่ยวข้องกับยาฟาวิพิราเวียร์ มีอยู่ 2 ฉบับสำคัญ ได้แก่ 1. สิทธิบัตรที่เกี่ยวข้องกับโครงสร้างออกฤทธิ์หลักของยา 2. สิทธิบัตรการผลิตในรูปแบบยาเม็ด
- สำหรับ “สิทธิบัตรที่เกี่ยวข้องกับโครงสร้างออกฤทธิ์หลักของยา” ตั้งแต่เดือน ส.ค. 2562 เป็นต้นมา ได้หมดอายุความคุ้มครองในทั่วโลกไปแล้ว นั่นหมายความว่า ใครก็สามารถนำโครงสร้างออกฤทธิ์หลักของยา ไปประกอบการผลิตยาชนิดใหม่ขึ้นมาได้
- ทว่าประเด็นปัญหาจริงๆ อยู่ที่ “สิทธิบัตรการผลิตในรูปแบบยาเม็ด” โดยบริษัทญี่ปุ่น ได้เข้ามา “ยื่นคำขอ” รับสิทธิบัตรยาฟาวิพิราเวียร์รูปแบบเม็ดเอาไว้ ตั้งแต่วันที่ 4 ก.ย. 2560 และจนถึงขณะนี้ก็ยังไม่สิ้นสุดกระบวนความพิจารณา
- นั่นหมายความว่า หาก อภ. ซึ่งมีความพร้อมในการผลิตยาฟาวิพิราเวียร์ ตัดสินใจนำยาออกมาขายเพื่อใช้ในประเทศ แล้วจู่ๆ กรมทรัพย์สินทางปัญญา กระทรวงพาณิชย์ เกิดอนุมัติสิทธิบัตรยาเม็ดให้กับบริษัทญี่ปุ่น ก็เท่ากับว่า อภ. “สุ่มเสี่ยงละเมิดสิทธิบัตร” บริษัทญี่ปุ่น เพราะสิทธิบัตรมีผลย้อนหลังนับตั้งแต่วันที่ยื่นคำขอ
- เครือข่ายภาคประชาสัง เครือข่ายวิชาชีพ แพทย์-เภสัชกร ตลอดจนนักวิชาการ จึงระบุตรงกันว่า 1. กรมทรัพย์สินทางปัญญา “ไม่ควรรับพิจารณาคำขอ” ตั้งแต่ต้นแล้ว 2. ถึงรับพิจารณามาแล้ว ก็ควรตีตก “ยกเลิกคำขอ” ทันที
- สาเหตุที่ระบุเช่นนั้น เนื่องจาก ทุกฝ่ายเห็นตรงกันว่าคำขอสิทธิบัตร “ยาชนิดเม็ด” ไม่เข้าเงื่อนไขการพิจารณา เพราะสิ่งประดิษฐ์ที่จะขอสิทธิบัตรได้นั้น จำเป็นต้อง 1. เป็นของใหม่ 2. มีขั้นตอนการพัฒนาที่สูงขึ้น
- ทว่า กรณีของยาฟาวิพิราเวียร์นั้น เป็นเพียงการดัดแปลงสูตรตำรับเล็กๆ น้อยๆ แล้วนำมาบรรจุในรูปแบบเม็ด ซึ่งถือว่าแทบไม่มีอะไรเปลี่ยนแปลง โดยในหลายประเทศก็ไม่ยินยอมให้บริษัทญี่ปุ่นขอสิทธิบัตรในประเทศของเขาเช่นกัน
- ผศ.ภญ.ดร.ยุพดี ศิริสินสุข อาจารย์คณะเภสัชศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย ในฐานะรองผู้จัดการศูนย์วิชาการเฝ้าระวังและพัฒนาระบบยา (กพย.) บอกกับ “The Coverage” ว่า ขณะนี้เราต้องคอยลุ้นว่าประเทศที่ไทยสั่งซื้อยาไปนั้นจะสามารถจัดส่งยามาให้ทันหรือไม่ หากไม่ทันก็คือประเทศไทยตายหมู่ เพราะจะไม่มียารักษาเลย ทั้งที่ตัวเองก็มีศักยภาพในการผลิต จึงขอเรียกร้องกรมทรัพย์สินทางปัญญา “ยกเลิก” คำขอสิทธิบัตรโดยทันที
- นพ.สุภัทร ฮาสุวรรณกิจ ประธานชมรมแพทย์ชนบท บอกกับ “The Coverage” ว่า ถ้าไทยสามารถผลิตยาตัวนี้ได้เองก็ช่วยลดค่าใช้จ่ายได้อย่างน้อยครึ่งหนึ่ง และยังจะทำให้ประเทศไทยนั้นกลายเป็นศูนย์กระจายยาให้กับประเทศเพื่อนบ้านได้
- ชมรมแพทย์ชนบท เรียกร้องว่า รัฐบาลควรประกาศสนับสนุน อภ.ให้เร่งผลิตยาตัวนี้อย่างเป็นทางการ หากกรมทรัพย์สินทางปัญญาไม่ปฏิเสธคำขอนี้ โอกาสที่จะถูกฟ้องในอนาคตก็มี ฉะนั้นรัฐบาลจึงควรแสดงความกล้าหาญทางการเมือง หนุนหลัง อภ.ผลิตยาเพื่อประชาชน
- รศ.ดร.ภญ.จิราพร ลิ้มปานานนท์ นายกสภาเภสัชกรรม บอกกับ “The Coverage ว่า คำขอนี้เป็นคำขอที่นำเอายาเก่ามาดัดแปลงเพียงเล็กน้อย แล้วบอกว่ายาตัวนี้เป็นยาใหม่ ซึ่งการทำเช่นนี้จะทำให้เขาสามารถต่ออายุสิทธิบัตรไปได้เรื่อยๆ จึงเรียกร้องให้กรมทรัพย์สินทางปัญญา “ยกเลิกคำขอ” โดยเร็ว และรัฐบาลต้องเป็นหลักพิงให้กับ อภ. ในการผลิตยาใช้เองในประเทศด้วย
- รศ.ดร.ภก.วิทยา กุลสมบูรณ์ ประธานมูลนิธิเภสัชชนบท บอกว่า การปลดล็อคเพื่อให้ อภ. ทำหน้าที่สร้างความมั่นคงทางยาในการผลิตยาฟาวิพิราเวียร์ เป็นเรื่องที่รัฐไม่สามารถหาเหตุผลใดมาหลีกเลี่ยงได้ กลับกันยังต้องแสดงบทบาทนำเพื่อบ่งบอกถึงความมุ่งมั่นที่จะรักษาชีวิตของประชาชนที่ได้รับภัยจากโควิด และทำให้บุคลากรที่เกี่ยวข้องกับการรักษาพยาบาลทั้งแพทย์และเภสัชกรมียาเป็นอาวุธในการสู้สงครามโควิด
- ทางด้านองค์การเภสัชกรรม ภญ.ศิริกุล เมธีวีรังสรรค์ รองผู้อำนวยการ อภ. บอกว่า ขณะนี้ อภ.ได้ดำเนินการผลิตยาฟาวิพิราเวียร์ชนิดเม็ดในระดับอุตสาหกรรมเรียบร้อยแล้ว ปัจจุบันอยู่ระหว่างไปศึกษาชีวสมมูลเพื่อเปรียบเทียบกับยาต้นแบบ คาดว่าจะขอขึ้นทะเบียนกับ อย. ได้ราว มิ.ย.-ก.ค. 2564 และสามารถจำหน่ายได้ทันทีที่ได้รับการขึ้นทะเบียน แต่ทั้งนี้ทั้งนั้นต้องไม่มีประเด็นเรื่องสิทธิบัตรยา
- ล่าสุด นายวุฒิไกร ลีวีระพันธุ์ อธิบดีกรมทรัพย์สินทางปัญญา ชี้แจงว่า บริษัทเอกชนได้ยื่นขอให้กรมฯ ตรวจสอบการประดิษฐ์เพื่อขอรับสิทธิบัตรยารูปแบบเม็ด แต่กรมได้ทำหนังสือตอบกลับไปเมื่อวันที่ 2 ก.พ. 2564 ว่า “สิทธิบัตรดังกล่าวไม่มีขั้นการประดิษฐ์ที่สูงขึ้น” โดยบริษัทผู้ยื่นคำขอสิทธิบัตรมีกรอบระยะเวลาในการชี้แจงถึง วันที่ 30 ส.ค. 2564 หากผู้ขอไม่ชี้แจงเข้ามาตามเวลาที่กำหนด จะถือว่าละทิ้งคำขอ
- นายนิมิตร์ เทียนอุดม ผู้อำนวยการมูลนิธิเข้าถึงเอดส์ บอกว่า “The Coverage” ว่า การรอให้ถึงวันที่ 30 ส.ค. 2564 เป็นเวลาที่นานไป และถึงแม้บริษัทผู้ขอรับสิทธิบัตรจะสามารถยื่นอุทธรณ์ได้ แต่ทางการไทยก็มีสิทธิตีตกไปก่อนได้เช่นกัน ยืนยันว่าการแก้ไขปัญหาที่ดีที่สุดคือการยกคำขอ และปฏิเสธไม่ให้สิทธิบัตรแก่บริษัทผู้ยื่นขอ
- ภก.สุภนัย ประเสริฐสุข ประธานชมรมเภสัชชนบท บอกกับ “The Coverage” ว่า ทั้งหมดนี้ต้องขึ้นอยู่กับการตัดสินใจของฝ่ายนโยบายและฝ่ายการเมือง โดยการตัดสินใจจะสะท้อนถึงความจริงใจกับบุคลากรทางการแพทย์ ว่าจริงใจกับเขามากน้อยขนาดไหน เพราะถ้าปลดล็อกคำขอสิทธิบัตรยาก็จะช่วยให้บุคลากรหน้างานมีอาวุธเพิ่ม มีขีดความสามารถเพิ่ม สามารถดูแลประชาชนและกลุ่มเสี่ยงได้ดียิ่งขึ้น
- ในขณะที่ยังไม่มีความชัดเจนว่าจะยกเลิกคำขอสิทธิบัตรหรือไม่ นายอนุทิน ชาญชีวรกูล รองนายกรัฐมนตรี และ รมว.สาธารณสุข ได้สั่งการให้ อภ. ไปคุยกับบริษัทญี่ปุ่น เพื่อหาช่องที่จะทำให้ไทยสามารถผลิตยาฟาวิพิราเวียร์ใช้เองในประเทศได้
- 4267 views